一般向け/高校生向け楽しい化け学
×
[PR]上記の広告は3ヶ月以上新規記事投稿のないブログに表示されています。新しい記事を書く事で広告が消えます。
今日も朝から塾でバイトでした。
朝7時前、塾に東大の化学の過去問がピラっと1大問分捨て置いてあったので解いてみることにしました。
朝から快調、一瞬で解けて爽快でした。
授業では習わない実験を題材にした問題だったんですが、計算や論理思考的内容は全然難しくなかったです。
方針だけさーっと立てたら後は計算してお終い。
しかし多くの高校生はほとんど実験を経験したことがなく実験がただ無機質な紙の上でのお話になってしまっているので現象が理解しにくくなっていて、実験系の問題は難しく思われがちです。
が、実験問題はむしろ数学に近い計算を要する結晶格子や化学平衡の問題よりずっと簡単だと思います。
実験は「実験」なんだから本来リアルなもの。
操作や現象を自然科学的目で追っていけば、入試に出る程度のロジックは難なくクリアできるはず。
百聞は一見に如かずといいますが、大学で実験してたらかなり強くなりました。
っと、朝から調子に乗っていたのですが、お得意様からwebフォームから投稿があってこのサイトのCODの自作問題の解答にミスがあったことが発覚。
その内容、なんと過マンガン酸カリウムの式量の計算ミス。
イタい・・・
申し訳なく恥ずかしいというのも然ることながら、この先の計算もポシャってしまっているのでもしこれが自分の入試だったらと考えると恐ろしい。
「ケアレスミスを完全につぶすと点数は14点アップする」とは言われる話。(何を基準かは知らんが)
計算ミス、ケアレスミス、勘違いはコケる素。
本当にもったいない。考える力はあったのに・・・
・・・っと塾生に教えている筆者がこうだからもう顔がない。
何度も徹底的に見直すというのが最善の方法かと。
それを怠った自分が情けない。
特に最近Q&AのQ1等も後日訂正を入れているので、そろそろ自分のたるみを締めなおさねばと思う。
ミスは信頼失墜の素。
嘘ばっかりの化学サイトは駄目である。
昔から注意力不足だといわれる筆者であるが、頑張ります。
だからミスっても温かく見守ってください・・・(ぉぃ
PR
明けましておめでとうございます!!!
1日は忙しくブログ更新できず、昨日のブログではナチュラルに忘れてて言い忘れてました!・・・・・
はい、ところでこのサイト、なんと本日で訪問者数3000を超えました!!!
本当に有難うございます!
最近ウェブフォームへの投稿も出てきたし、ついにちょっとはまともな化学サイトになってきたような・・・
でもまだまだです、皆様今年も宜しくお願い申し上げます。
さてさて、三が日だというのに今日は塾でバイトでした。
で、今年最初の化学の問題を解かせると、塾生達は結構中和滴定にてこずってました。
等量点を求める中和滴定は基本的に式が
(H+の物質量)=(OH-の物質量)
って言うのしかありません。
あとは薄めるとか何とか、この式で求めたモル濃度や滴下量に飾りが付くだけです。
例えば次のようなときに迷うようです;
「C mol/lのH2SO4 V mlを滴定するのにC’mol/l の水酸化ナトリウムがV’ml必要であった。」
酸や塩基の価数が変わると難しいようで、2倍するのか1/2倍するのか迷うようです。
しかし、この場合なら硫酸1分子は2つのH+を発生するので、上の式で考えると
2CV = C’V’
となります。
何も難しくありません。
単にH+とOH-の量を考えただけです。
たぶんこのことさえ完璧にわかればほとんどの中和の問題が解けてしまうと思います。
逆滴定など、いろんな種類の酸や塩基を加えた場合でもこの考え方で簡単に解けてしまいます。
よく、
(酸の価数)×(酸のモル濃度)×(酸の体積)
=(塩基の価数)×(塩基のモル濃度)×(塩基の体積)
という公式を見かけますが、これはまさに上のH+とOH-の量の考え方です。
この式を覚えておくと迷わなくて良いですが、公式を覚えるだけというのは応用性がないです。
逆滴定などややこしい操作が挟まれるとたちまちわからなくなります。
だから
(H+の物質量)=(OH-の物質量)
というのを理解して使いこなせるようにしましょう。
これが最も応用が利きます。
なお、
(酸の価数)×(酸のモル濃度)×(酸の体積)
=(塩基の価数)×(塩基のモル濃度)×(塩基の体積)
の式の出てくる「(酸の価数)×(酸のモル濃度)」は、ある意味酸が出しうるH+の濃度を表します。
すなわち単位体積当たりの或る酸の水溶液のH+を出す能力を表します。
これを酸の能力を考慮した"新しく決めなおした濃度"、その名も「規定度」と呼びます。
同様に塩基の場合も(塩基の価数)×(塩基のモル濃度)を塩基の規定度と定義します。
すると上の公式は
(酸の規定度)×(酸の体積)=(塩基の規定度)×(塩基の体積)
というように簡略化されます。
これは非常に便利で、大学の滴定の実験ではこればっかり使います。
例えば「0.050 mol/lのリン酸」と問題に出てきたらそのリン酸の規定度は
(リン酸の規定度) = 0.050 mol/l × 3 = 0.15 mol/l (=0.15 N)(←単位は"N"とも書かれます。)
となります。
また「0.20 mol/lの水酸化バリウム」は
(水酸化バリウムの規定度) = 0.20 × 2 = 0.40 mol/l (=0.40 N)
となります。
これは非常に便利で、これだけ定義しておくと、
「そのリン酸水溶液10.0 mlを滴定するためにその水酸化バリウム水溶液はV ml必要だった。」
と出てきたら
(リン酸の規定度)×(リン酸の体積)=(水酸化バリウムの規定度)×(水酸化バリウムの体積)
⇒ 0.15 N × 10.0 ml = 0.40 N × v ml
⇒ v = 3.75 (ml)
と簡単に出てきます。
(ちゃんと単位を書いたら、わざわざリットルに直さなくてもmlのままで簡単に計算できます。結構これが出来ない人が多い。)
こうしたら「物質量の比は・・・割るんだっけ掛けるんだっけ・・・」っと悩むこともありません。
同じ考え方で酸化還元滴定にも使えるんですが、むしろそっちのほうが重宝するかも・・・
っと、結構使える規定度です。
ちなみに昔は高校でも教えてたらしいです。
また今度規定殿使い方を酸化還元滴定の場合も含めてまとめてコラム書こうかな。
ただし、一番大切なことは、公式ではなく(H+の物質量)=(OH-の物質量)等の根本的な関係を理解することです。
今年ももう終わりです。
今筆者がコレを打ち込んでいる時点で、2010年はあと1時間半を切りました。
そして・・・
あんなにカッコ付けて答えたのに、ウェブ拍手でのQ1の質問を重要なミスをしていました・・・
「濃度が低いとき」と表記すべきところを「濃度が高いとき」と間逆に書いていたことです。
結論に繋がる重要なところで間違えて、大変迷惑をおかけしました。申し訳ございません。
しかし、直してもやはり文章がしっくり来ない。
たぶんみなさんにはもっと理解しがたい文章になっているでしょう。
すみません、まだまだ説明下手くそです。
うまくなりたいなぁ・・・精進します・・・・
っと、大晦日にネガティブなことばっかり書いても駄目ですね。
そうそう、
風邪引きました。
くそう・・・これもネガティブ感MAX・・・
今日は塾のバイト中ずっと咳してました・・・・
しかし風邪を引こうが化け学する筆者です。
今日は、朝6時ごろから延々と糖類について考えてました。
フルクトース
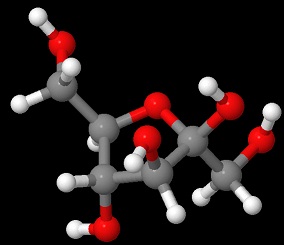
Jmolで描画
Jmolで描画
「アルデヒド基のないフルクトースがなぜ還元性を持つのか」という問いに答えられるでしょうか。
高校化学の教科書や参考書にはおそらく「-CHOはないが、直鎖型の時の-CO-CH2-OHに還元性がある」と、ぼかして書いてあると思います。
ではなぜ-CO-CH2-OHに還元性があるのでしょうか。
フルクトース銀鏡反応を示すので、塩基性条件下で-CO-CH2-OHに還元性が発現するように色々反応機構を考えてみました。
すると、高校化学では難しいのですが、どうにも-CO-CH2-OHが「エノールがケトンになる」という有名な反応を逆向きに進んで-C(O-)=CH-OHになり、-C(OH)=CH-O-になり、それが次に左側の-OHが残るようにエノールが異性化すると-C(OH)-CHOとなります。
するとあらあら不思議、Hと二重結合の場所が変わって還元性のアルデヒド基が出てきました。
コレは塩基性条件で起こりやすいなあ・・・っとバイト先で考えていました。
そしてさっき調べるとどうやら合っているっぽいです。
この反応、その名も
ロブリー・ドブリュイン-ファン エッケンシュタイン転位
噛めずに一発で言えたあなたはアナウンサーに向いています。
このやたら長い名前の転移反応によりフルクトースは分子内にアルデヒド基を作れるので還元性を持つことが出来るのです。
・・・っと、朝っぱらから反応機構考えていたりした大晦日でした。
一昨日ウェブ拍手で質問が来ました。
知人友人以外からのは初めてでした。
質問・回答は新設したQ&A(ウェブ拍手レス)に載せてます。
今日は本当は朝から塾でバイトだったんですが、生徒が休んだため急きょ休みとなりました。
そのため朝から頑張って回答したのですが・・・
急いで作るとミスりますね。
「OH+」とか斬新なこと書いてました。
(ちなみにOH+イオンはトリチウム水H-O-Tがベータ崩壊するときに発生するらしいよ!)
そして、回答して数時間後その質問者さんから返信がありました;
丁寧に質問に答えていただいて感激です!ありがとうございました!
pHの測定が0.02刻みが限界ということは知りませんでした。勉強になりました!(●●●(←伏せときます)という本を使っているのですが、やはり載っていませんでした)
僕は浪人中で、このサイトはとても勉強の励みになってます。」
感動・・・
このサイトやってて良かった・・・
Q1さん>>
本当に丁寧な返信有難う御座います。。。
このサイトはまだ開設から半年も経たない、筆者共々未熟なサイトです。
なのに読んでくれてて、こんな風に感じてくれる人がいることは筆者冥利に尽きます。
御意見・御感想・ご質問等あれば気軽にトップページのwebフォームから投稿下さい。
ただし回答が遅れてしまうこともあるかと思いますがご了承下さい。。。
ちなみに今回の質問でのpH測定の限界について。
大学の分析化学において「誤差」や「信頼性」、「正確さ」、「測定限界」というものは非常に重要になってきます。
pHの場合は割と値が適当なようなことになっていますが、分析対象によってはナノmol単位を凄い高精度で測定する必要も生じてきます。
が、それら「誤差」等の内部事情的なことは大学に入らないと、高校の教科書には載っていないのでわかりません。
高校の教師や予備校の講師、高校の参考書を書く人は「受験用の勉強」を教授するための人であって化学者ではありません。
なのでそれらについては余計ややこしくするだけなので触れません。
が、「化学」というものは本来「範囲」とかいうのはありません。
大学に入ると自分のやりたい学問、筆者の場合なら「化学」を思う存分勉強することができます。
ここでの「勉強」は入試のためとか点数を取るためのものではありません。
ただただ興味・関心につられて「学ぶ」ということです。
だが、しかし、but、それに行き着くためには受験勉強をして大学に入らねばなりません。
受験のための「基本的な素直な勉強」をするのなら、やはり高校の範囲にとらわれた勉強が良くなります。
こだわるとややこしくなってしまうことがあります。
ややこしくならないための「基本的な素直な勉強」は高校の教師や予備校の講師、高校の参考書を書く人が得意とします。
一方このサイトでは時にはあえてこだわってみたりしたいと思います。
なぜならそれが「学問」だから。
「実はこんなことになっているのか!」とか「へぇ~大学ではこんなことまで考えるのか~」とか、何か発見できるような記事を書くのを目標としています。
それが学問の"楽しい"というところに繋がるのではなかろうか、と思います。
なんしか大学は面白い:面白くあるべきなので受験勉強は頑張って下さい。
個人的には
「○○大学が賢いから行きたいけど、希望の□□学科は難しいからあきらめて△△学科にしよう」
というのはやめたほうがいいと思います。
「筆者は」(あくまで個人的な意見ですが)、賢い大学でも自分の希望する学問分野を変えるくらいならランクを落としてでも他の大学の希望する学科に行くべきではないかと思います。
もちろんランクを落とすという弱気なことは良くないですが・・・
たぶん違う学科に行ってあまり興味のないことを勉強することになって、大学で成績不振になるとそっちのほうが就職等へ大きなダメージを加えます。
一番大事なことは自分のしたい学問を専攻することだと思います。
人生は長いので、長期的な目で見て、自分の人生はどうやったら面白くなるのだろうかと考えるのが大切かと思います。
Q1さん>>
どんな学科に興味があるのでしょうか。
進みたい道はそれぞれですが、ぜひそれを専攻できるように受験勉強頑張って下さい!!
今日は、筆者の勤める塾の或る高校三年生の生徒さんの最終授業となりました。
理由は・・・
全入試が終わったから!!
そして先週、第二志望の合格はゲット!
素晴らしい。
とりあえずしばらくのんびりして受験の疲れを抜くべきですね。
が、大学に入ってからも戦いは続く、というか真の戦いに突入していくので気は抜けぬ。
一方筆者はというと月曜からさっそく寝不足で・・・
昨日の晩、クロマトグラフィーの結果を集計しつつ、その結果が各分子と一致するかを延々と分子軌道計算したりで・・・
特に双極子モーメント(分子の極性の指標)や紫外線を当てたときの変化などを考えていました。
気づいたら朝7時。
寝ずに慌てて学校へ・・・
大学生も忙しいのです。。。
最新記事
(2018/09/23)
(2017/08/14)
(2017/03/07)
(2016/08/17)
(2016/05/05)
(2015/07/19)
(2015/04/11)
(2014/11/23)
(2014/08/03)
(2014/05/11)
カテゴリー
ブログ内検索
