一般向け/高校生向け楽しい化け学
×
[PR]上記の広告は3ヶ月以上新規記事投稿のないブログに表示されています。新しい記事を書く事で広告が消えます。
なんと今日もウェブフォームに質問が・・・
いやぁ、なんとまぁ、このサイトも日の目を見るようになってきたんですねぇ~
まあまだまだですが、いつかその道での人気サイトになればいいなぁとか思ってます。
読者のみなさん、有難うございます!
さてさて、
風邪が治りません。。。
今日もアセトアミノフェンのお世話になりました。
と言うことでみんなのヒーロー:アセトアミノフェンをご紹介。
今日の分子 No.36 アセトアミノフェン C6H4(OH)(NHCOCH3)
解熱鎮痛薬の一種。
先月の「今日の分子No.33」で紹介したアセトアニリドの、p位にヒドロキシ基が導入されたバージョンである。
アセトアニリドが強い副作用を持つのに対し、アセトアミノフェンの毒性は低い。
・・・っというのは高校化学でも習うほど有名で実用的な物質である。
今現在、たぶん筆者の胃に入っている。
発熱や寒気を止めてくれる効果があり、筆者のあと少ししたら効いてきて筆者の頭痛をやわらげてくれるはずだ。
アセトアミノフェンを服用しているときはアルコールを摂ってはいけないらしい。
最悪死にいたるとか・・・風邪薬飲ませて酒飲ませるっていうサスペンスもあった気がします。
筆者は昨日もアセトアミノフェンを飲んでいたため、残念なことに正月で親戚と集まったのにお酒を飲めなかった。
アスピリン・アセトアニリド・アセトアミノフェンはお薬分子としてセットで覚えよう。
この三物質はシクロオキシゲナーゼという酵素の活性を下げるという点で基本的に同じ効果であるらしいが、
残念ながら専門ではない筆者にはよくわからない。
ちなみにアセトアニリドは体の中でアセトアミノフェンになるらしい。
だから最初からアセトアミノフェンを飲んだほうが毒性低いし即効性高くて効率良い!!
ってことなんでしょうか。
やはり専門でない領域はわかりません。
昔は、筆者の先生たちが学生であった時代は風邪を引くと研究室の反応試薬のアセトアニリドを飲んでいたらしい。
せめてアセトアミノフェンを飲めばよかったのに・・・
Q1さん>>
医学部頑張ってください!
入学して医薬品学習ったらコイツらの体内での反応教えてください!
PR
今年ももう終わりです。
今筆者がコレを打ち込んでいる時点で、2010年はあと1時間半を切りました。
そして・・・
あんなにカッコ付けて答えたのに、ウェブ拍手でのQ1の質問を重要なミスをしていました・・・
「濃度が低いとき」と表記すべきところを「濃度が高いとき」と間逆に書いていたことです。
結論に繋がる重要なところで間違えて、大変迷惑をおかけしました。申し訳ございません。
しかし、直してもやはり文章がしっくり来ない。
たぶんみなさんにはもっと理解しがたい文章になっているでしょう。
すみません、まだまだ説明下手くそです。
うまくなりたいなぁ・・・精進します・・・・
っと、大晦日にネガティブなことばっかり書いても駄目ですね。
そうそう、
風邪引きました。
くそう・・・これもネガティブ感MAX・・・
今日は塾のバイト中ずっと咳してました・・・・
しかし風邪を引こうが化け学する筆者です。
今日は、朝6時ごろから延々と糖類について考えてました。
フルクトース
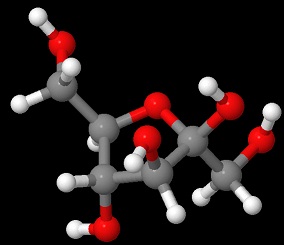
Jmolで描画
Jmolで描画
「アルデヒド基のないフルクトースがなぜ還元性を持つのか」という問いに答えられるでしょうか。
高校化学の教科書や参考書にはおそらく「-CHOはないが、直鎖型の時の-CO-CH2-OHに還元性がある」と、ぼかして書いてあると思います。
ではなぜ-CO-CH2-OHに還元性があるのでしょうか。
フルクトース銀鏡反応を示すので、塩基性条件下で-CO-CH2-OHに還元性が発現するように色々反応機構を考えてみました。
すると、高校化学では難しいのですが、どうにも-CO-CH2-OHが「エノールがケトンになる」という有名な反応を逆向きに進んで-C(O-)=CH-OHになり、-C(OH)=CH-O-になり、それが次に左側の-OHが残るようにエノールが異性化すると-C(OH)-CHOとなります。
するとあらあら不思議、Hと二重結合の場所が変わって還元性のアルデヒド基が出てきました。
コレは塩基性条件で起こりやすいなあ・・・っとバイト先で考えていました。
そしてさっき調べるとどうやら合っているっぽいです。
この反応、その名も
ロブリー・ドブリュイン-ファン エッケンシュタイン転位
噛めずに一発で言えたあなたはアナウンサーに向いています。
このやたら長い名前の転移反応によりフルクトースは分子内にアルデヒド基を作れるので還元性を持つことが出来るのです。
・・・っと、朝っぱらから反応機構考えていたりした大晦日でした。
一昨日ウェブ拍手で質問が来ました。
知人友人以外からのは初めてでした。
質問・回答は新設したQ&A(ウェブ拍手レス)に載せてます。
今日は本当は朝から塾でバイトだったんですが、生徒が休んだため急きょ休みとなりました。
そのため朝から頑張って回答したのですが・・・
急いで作るとミスりますね。
「OH+」とか斬新なこと書いてました。
(ちなみにOH+イオンはトリチウム水H-O-Tがベータ崩壊するときに発生するらしいよ!)
そして、回答して数時間後その質問者さんから返信がありました;
丁寧に質問に答えていただいて感激です!ありがとうございました!
pHの測定が0.02刻みが限界ということは知りませんでした。勉強になりました!(●●●(←伏せときます)という本を使っているのですが、やはり載っていませんでした)
僕は浪人中で、このサイトはとても勉強の励みになってます。」
感動・・・
このサイトやってて良かった・・・
Q1さん>>
本当に丁寧な返信有難う御座います。。。
このサイトはまだ開設から半年も経たない、筆者共々未熟なサイトです。
なのに読んでくれてて、こんな風に感じてくれる人がいることは筆者冥利に尽きます。
御意見・御感想・ご質問等あれば気軽にトップページのwebフォームから投稿下さい。
ただし回答が遅れてしまうこともあるかと思いますがご了承下さい。。。
ちなみに今回の質問でのpH測定の限界について。
大学の分析化学において「誤差」や「信頼性」、「正確さ」、「測定限界」というものは非常に重要になってきます。
pHの場合は割と値が適当なようなことになっていますが、分析対象によってはナノmol単位を凄い高精度で測定する必要も生じてきます。
が、それら「誤差」等の内部事情的なことは大学に入らないと、高校の教科書には載っていないのでわかりません。
高校の教師や予備校の講師、高校の参考書を書く人は「受験用の勉強」を教授するための人であって化学者ではありません。
なのでそれらについては余計ややこしくするだけなので触れません。
が、「化学」というものは本来「範囲」とかいうのはありません。
大学に入ると自分のやりたい学問、筆者の場合なら「化学」を思う存分勉強することができます。
ここでの「勉強」は入試のためとか点数を取るためのものではありません。
ただただ興味・関心につられて「学ぶ」ということです。
だが、しかし、but、それに行き着くためには受験勉強をして大学に入らねばなりません。
受験のための「基本的な素直な勉強」をするのなら、やはり高校の範囲にとらわれた勉強が良くなります。
こだわるとややこしくなってしまうことがあります。
ややこしくならないための「基本的な素直な勉強」は高校の教師や予備校の講師、高校の参考書を書く人が得意とします。
一方このサイトでは時にはあえてこだわってみたりしたいと思います。
なぜならそれが「学問」だから。
「実はこんなことになっているのか!」とか「へぇ~大学ではこんなことまで考えるのか~」とか、何か発見できるような記事を書くのを目標としています。
それが学問の"楽しい"というところに繋がるのではなかろうか、と思います。
なんしか大学は面白い:面白くあるべきなので受験勉強は頑張って下さい。
個人的には
「○○大学が賢いから行きたいけど、希望の□□学科は難しいからあきらめて△△学科にしよう」
というのはやめたほうがいいと思います。
「筆者は」(あくまで個人的な意見ですが)、賢い大学でも自分の希望する学問分野を変えるくらいならランクを落としてでも他の大学の希望する学科に行くべきではないかと思います。
もちろんランクを落とすという弱気なことは良くないですが・・・
たぶん違う学科に行ってあまり興味のないことを勉強することになって、大学で成績不振になるとそっちのほうが就職等へ大きなダメージを加えます。
一番大事なことは自分のしたい学問を専攻することだと思います。
人生は長いので、長期的な目で見て、自分の人生はどうやったら面白くなるのだろうかと考えるのが大切かと思います。
Q1さん>>
どんな学科に興味があるのでしょうか。
進みたい道はそれぞれですが、ぜひそれを専攻できるように受験勉強頑張って下さい!!
今日友達とリチウムイオン電池の溶媒のお話になったのでそれについて。
今日の分子 No.35 炭酸エチレン C3H4O3
珍しい形の分子に見えるが、炭酸(H2CO3)とエチレングリコール(HO-CH2CH2-OH)が二ヶ所エステル結合で繋がっただけの分子。
だから名前は炭酸エチレン。
別名で1,3-ジオキソラン-2-オンやエチレンカーボネートとも呼ばれる。
極性のある有機溶媒であり、リチウムイオン電池でリチウムイオンを溶かすための電解液として使われる。
ちなみにこの分子、筆者が受けた阪大プレ(だったような気がする・・・)の模擬試験で出てきた経験があります。
極性を答えさせるものだったかな・・・ちょっと記憶が怪しい・・・
大きな極性がなければイオンを溶かすことは出来ない。
水が食塩を溶かすことが出来るのは、水分子が強く分極していて極性溶媒となっているからである。
水分子はH-O結合においてOが強くHから電子を引っ張っているので分極しているため極性が現れる。
(あと分子が点対称でないのも要因になっている。)
ここで極性の大きさの指標として「双極子モーメント」(単位はdebye)という物理量が定義されている。
一般に双極子モーメントの数値が大きいほどその分子は極性が大きいと言える。
例えば水の双極子モーメントは1.94 debyeである。
他に例えば硫化水素は1.02 debye、エタノールは1.47 debyeである。
この数値の比較により、水はかなり極性の大きな分子でありイオンや他の極性分子を良く溶かすだろうと予想される。
実際、水は極性が非常に大きく優れた極性溶媒であるとされている。
では、この炭酸エチレンはどうだろうか。
分子軌道計算ソフトWinMOPAC
結果、4.616 debye
デカイ!!!!
半端なく大きい値である。
水の1.94 debyeでさえ異常に大きな双極子モーメントだと言われるのに、炭酸エチレンはケタ違いに大きな双極子モーメントを持っている。
すなわち炭酸エチレンはイオンを溶かすのがズバ抜けて得意な溶媒なのである。
だからリチウムイオン電池でリチウムイオンを溶かすための溶媒として使われているのである。
一方、溶媒としては優秀な炭酸エチレンにも欠点がある。
炭酸エチレンは引火性の油であり、非常に燃えやすいという危険性があるのだ。
少し前にパソコンのリチウムイオンバッテリーが発火しリコールがかかって回収になったりしていましたが、これは熱を放散しにくい構造/状況になったリチウムイオンバッテリーが高熱になり炭酸エチレンが発火したからだと言われています。
しかし炭酸エチレンほどリチウムイオンを溶かすことの出来る優秀な溶媒はそうないので、この危険性をいかに抑えるかという対策を考えつつ炭酸エチレン若しくは類似の極性有機溶媒を使い続けるしかないのです・・・
※ 某大学の教授がリチウムイオン電池の「全固体化」に成功したとか。
要するに液体フリーで発火の危険性なし!という優れもの。
まだまだ身近なところにも化学の力で何とかなる問題が転がっています。
一昨日のブログで紹介した『世界で一番美しい元素図鑑
美しい・・・本当にすばらしい・・・
オールカラー!
そしてキラキラ!
黒バックに金属の写真というのが多いのですが、それが本当に美しい。
原子量やスペクトル・用途に加え、著者の体験や豆知識などが盛りだくさん。
あと著者が天才というか、ちょっと変な人(と言ったら失礼であるが・・・)で、やたらと元素なギャグやオタクっぷりもたくさん書いています。
大学の友人と半日読んで遊んでました。
本当に面白いし勉強になります。
バイト先の塾の塾長とも読んで遊んでたんですが、塾長殿も大変気に入られたようです。
なんてったって著者の元素への愛着、愛でっぷりがホントにスゴイ。
著者はイグノーベル賞(面白研究賞的な)受賞者であり、本当に面白い方です。
ぜひぜひ自分の目で読んでみてください。
想像以上の美しさと面白さに出会えます。
最新記事
(2018/09/23)
(2017/08/14)
(2017/03/07)
(2016/08/17)
(2016/05/05)
(2015/07/19)
(2015/04/11)
(2014/11/23)
(2014/08/03)
(2014/05/11)
カテゴリー
ブログ内検索
