一般向け/高校生向け楽しい化け学
×
[PR]上記の広告は3ヶ月以上新規記事投稿のないブログに表示されています。新しい記事を書く事で広告が消えます。
寒いですねえ・・・
空気分子の運動がショボくなった証拠ですね。
実は熱(温度)というのは分子の運動の度合に関係しています。
たとえば熱いお湯に指を漬けて熱く感じるのは、激しく動く水分子が指に激しくぶつかるからです。
温度が高いほど分子は激しく運動します。
1℃上がるごとにどれほど分子の運動が激しくなるかはその分子固有(気体では分子の質量;分子量に依存)です。
では空気の分子はどれくらいの激しさ(速さ)で運動しているのでしょうか。
気体分子の平均の速さvは、気体定数をR[Jmol-1T-1]、絶対温度をT[K]、モル質量をM[kg/mol]とすると
v = √(2RT/M)
と表されます。
空気は平均分子量が約29なので、簡単のため空気が分子量29の単分子で構成されていると仮定します。
温度が常温25℃(T=298K)のとき、上式に代入すると
v常温 = 413 m/s
なんと常温では空気分子は音速以上の速さで動き回っているのです!
また、寒い冬(5℃)、暑い夏(36℃)で同じように計算してみると、
v冬 = 399 m/s
v夏 = 421 m/s
となります。
夏と冬では分子の運動は秒速20m以上違うのです。
そりゃ冬は寒いわ。
◎ 参考
- 『バーロー物理化学〈上〉』
, Gordon M. Barrow (著), 大門 寛 (翻訳), 堂免 一成 (翻訳), 東京化学同人; 第6版 (1999/03)
PR
放課後化学講義室「演習」のページに置いてある問題/解答をPDFファイルにしました!
これで体裁が奇麗になったし、分数を見やすい様に変更!
そして・・・またやられた・・・
硫酸の野郎め・・・まさか靴まで飛んでやがったとは・・・
今朝靴履くときに、靴が円形に穴空いてました・・・
てなわけで今日は憎き硫酸を紹介。
今日の分子 No.32、硫酸 H2SO4
酸化数Ⅵの硫黄のオキソ酸。
硫酸の工業的製法は接触法と呼ばれ、高校化学では重要。
1. 硫黄の酸化
S + O2 → SO2
2. 二酸化硫黄の酸化(酸化バナジウム(Ⅴ)触媒下)
2SO2 + O2 → 2SO3
3. 三酸化硫黄の水への吸収
SO3 + H2O → H2SO4
☆ 濃硫酸にさらに三酸化硫黄を吸収させて得る硫酸を発煙硫酸という。
通常のブレンステッド酸の中ではかなりな強酸である。
さらに熱濃硫酸には酸化作用があり、
H2SO4 + 2H+ + 2e- → SO2 + 2H2O
という反応で還元されて二酸化硫黄を発生する。
すなわち酸化力のある酸であるため銅や銀とも反応できる。(※鉛は表面に不溶性塩を作るため溶けない。)
また濃硫酸には脱水作用があり、物理的な乾燥剤として用いられたり脱水反応の触媒として用いられる。
・糖(グルコース)の炭化;
C6H12O6(グルコース) → 6C + 6H2O
・アルコール(エタノール)の脱水縮合(130℃);
2CH3CH2OH → CH3CH2OCH2CH3 + H2O
・アルコール(エタノール)の脱水(180℃)
CH3CH2OH → CH2=CH2 + H2O
不揮発性の酸であるため、希硫酸であっても乾燥して濃硫酸となり脱水作用や酸化作用を示すことがある。(前日の記事参照)
他にも、(求核性のない)酸として・スルホン化剤として・硫酸エステル化剤として・ニトロ化剤として(硝酸と混合;混酸)幅広く使われ、非常に重要な化学物質である。
◎ 希硫酸と濃硫酸の使い分け
希硫酸は酸として使い、濃硫酸は酸化剤・乾燥剤・脱水反応触媒として使う。
ただし、濃硫酸は加熱しなければ酸化作用を発揮しない。
硫酸にやられた・・・ジーンズに穴が開きました・・・
憎き硫酸の図
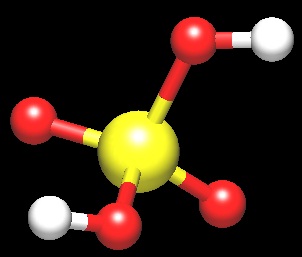
WinMOPACで計算・描画 ※二重結合省略
WinMOPACで計算・描画 ※二重結合省略
ポツポツポツと大小5箇所の穴が空きました。
濃硫酸には脱水作用があるため服に付いたら穴が開き、砂糖にかけたら炭化してしまいます。
もちろん皮膚に付いたら火傷を負います。
しかも硫酸のタチの悪いところは、不揮発性であるため服などに希硫酸が付いた状態でしばらく置いておくと
水分だけが飛び濃硫酸になり、時間差でその攻撃力を発揮するところです。
おそらく硫酸が付いたのは一週間前。
ジーンズのフトモモの部分に落ちた小さな硫酸滴が乾燥して濃硫酸になり、3日後くらいにその猛威を振るったようです。
実験の教科書も硫酸が付いたときは単に「濡れたかな?」くらいでしたが、数日後に開いてみるとその部分がボロボロと崩れ落ちて穴が開くという始末・・・
皆さんも硫酸の野郎には気をつけましょう!!
YouTubeで面白い動画発見。
いろんな意味でかなりヤバイ。
塩素酸カリウムとグミを反応させるらしい。
※ 音量注意、かなり激しく反応します。
Potassium Chlorate and Gummy Bear
※絶対に真似しないでください。
やばくね?
コーラにメントス入れてシュワアアアア!!!っとはワケが違うぜ!!!
こういうことよく外人さんがやってYouTubeとかに投稿するけど、今まで見た中で一番ひどかった・・・
塩素酸カリウムとはKClO3という塩素酸(HClO3)の塩。
強力な酸化剤で、第一類危険物第一種酸化性固体、危険等級Ⅰの超危険物質なのだ!!
塩素酸カリウムは決して加熱したり有機物に触れさせてはならない。
急激な酸化反応が起こり、爆発的に反応する。
が、動画では思いっ切り加熱して有機物(グミ)を突っ込んでる・・・
たぶんグミじゃなくても有機物なら大概こんな風になるような気がする。
しかし赤く光って綺麗・・・じゃなくてかかわいい熊さんグミに何てことするんだ!!!
そして再度注告、ぜったいに真似してはいけません!
◎ 参考
- 『チャレンジライセンス乙種1・2・3・5・6類危険物取扱者テキスト』
, 工業資格教育研究会, 実教出版; 改訂版 (2005/10)
分子軌道計算ソフト「WinMOPAC
本来は分子の構造を最適化(妥当な角度・結合角を計算)して分子の形;結合距離や結合角度、種々の計算;生成熱や極性・分子軌道を算出するためのソフトである。
このブログでもこのソフトで分子の形を計算して載せていることが多い。
例えば昨日・一昨日のリン酸や十酸化四リンもこのソフトで計算したものである。
が、この計算能を悪用(?)すると結構遊べる。
結合角や距離を連続的に変化させて分子の形を予想する「Reaction」という機能があるが、これに有り得ない極端な変化をさせることによって、二重結合を無理やりねじ切ったり結合を引きちぎったりするシミュレーションが出来る。
今日はベンゼンを拷問にかけてみました。
彼のC-C-C・C-C-C二面角度を捻じ曲げてみよう。
うおー分子がひしゃげてきた!
そして・・・ぐちゃ
なぜか結合が組み変わり意味不明な物質に!?
哀れベンゼンは脱臼(??)して無残な姿に・・・
次にC-C結合を無理やり引っ張って伸ばしてみよう。
右上のC-C結合を引っ張ります。
早速結合がぶちきれた!!
人間で言うと肩が裂けたようなもの・・・そして・・・
まさかの分裂!!
哀れベンゼンは真っ二つに千切れてしまいました・・・
なんだかベンゼンが可愛そうになってきたから今日はもうやめとこう・・・
>> <無記名>様への拍手レス
最新記事
(2018/09/23)
(2017/08/14)
(2017/03/07)
(2016/08/17)
(2016/05/05)
(2015/07/19)
(2015/04/11)
(2014/11/23)
(2014/08/03)
(2014/05/11)
カテゴリー
ブログ内検索
